
我们的核心产品AN2025是一种泛PI3K抑制剂,目前正在进行全球多中心临床三期试验。该产品从诺华引进,我们拥有开发和商业化AN2025的全球独占权利。在抗PD-1/PD-L1类药物治疗后疾病进展的复发或转移性头颈鳞癌治疗的候选药物中,AN2025的研发进度是最领先的。AN2025一旦获得批准,将成为全球首款针对该适应症的产品,从而解决这一未满足的医疗需求,并占据可观的市场份额。2023年4月,我们与日本化药签订选择权协议,以进一步推进该候选药物在日本的商业化进程。
AN2025 BURAN 针对抗PD-1/PD-L1治疗后的HNSCC的临床3期研究(NCT04338399)
BURAN 研究是一项随机、非盲的临床三期研究,旨在评估每周一次紫杉醇与每日一次的AN2025联用,对比单独每周一次紫杉醇,在以下难治性、复发性或转移性头颈部鳞癌患者中的治疗效果:
1) 曾进行抗 PD-(L)1单药治疗;
2) 曾进行抗 PD-(L)1治疗与铂类化疗联用治疗;或
3) 抗 PD-(L)1之后的序贯治疗,无论是在铂类化疗之前或之后
2023年11月,我们完成了Buparlisib (AN2025) 联合紫杉醇治疗复发性或转移性头颈部鳞状细胞癌(HNSCC) 的全球III 期临床试验 (BURAN)全部483名患者入组。该试验遍及全球180多家研究中心,涵盖北美、欧洲、亚洲和南美18个主要市场。入组患者以2:1的比例随机接受AN2025(100 mg,每日一次)+紫杉醇(80 mg/m2,每周一次)联合治疗和紫杉醇单药治疗(80 mg/m2,每周一次),治疗周期为21天。该研究的主要终点是整个(意向治疗)患者人群的OS,次要终点包括安全性特征和其他疗效指标,如PFS、ORR、DoR和HRQoL。
BERIL-1 研究(r/m HNSCC的临床二期试验)(NCT01852292)1,2
本试验是一项多中心、随机、双盲、安慰剂对照的二期研究,旨在评估既往铂类化疗方案治疗期间或之后出现的经组织学或细胞学证实的复发性或转移性头颈鳞癌患者。研究在18个国家和地区的58个研究中心开展,共入组158例符合条件的患者,患者在28天治疗周期内随机(1:1)接受二线口服AN2025(n=79,76例接受100 mg,每日一次)或安慰剂(n=79,78例接受80 mg/m2,第1、8、15和22天接受治疗)联合紫杉醇静脉给药。
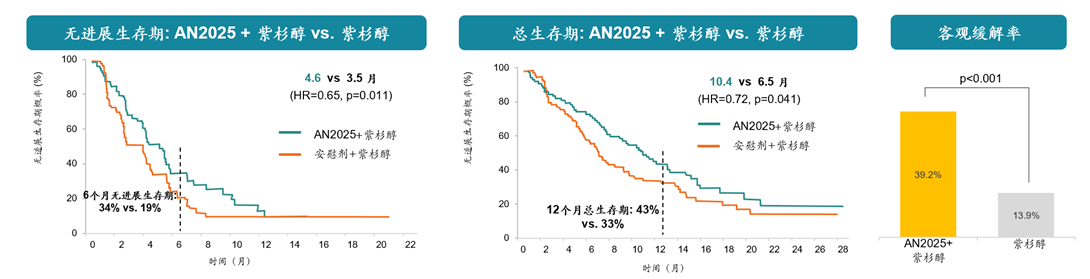
临床数据表明,AN2025联合紫杉醇治疗的总生存期(mOS)超过10个月(而安慰剂加紫杉醇组为6.5个月),无进展生存期(mPFS)为4.6个月(而安慰剂加紫杉醇组为3.5个月),客观缓解率(ORR)为39.2%(而安慰剂加紫杉醇组为13.9%)。
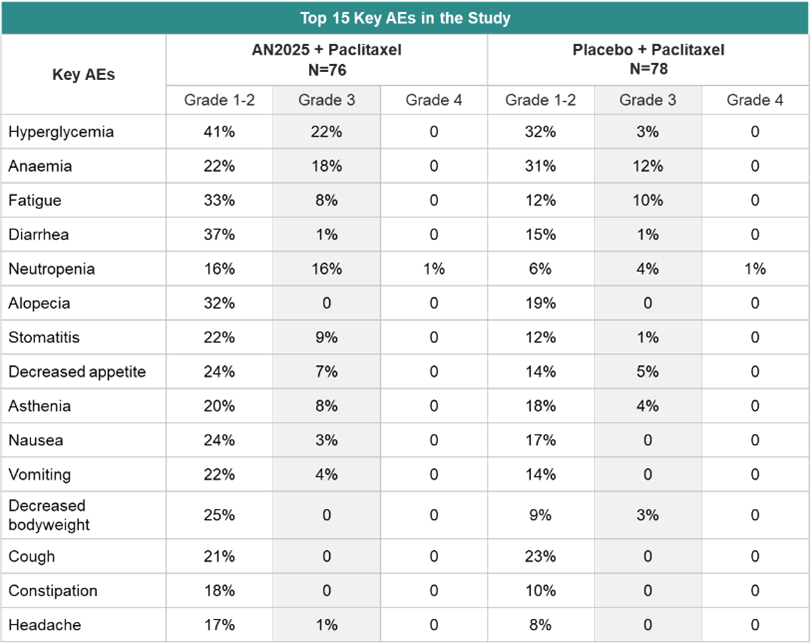
安全性数据表明,当AN2025与紫杉醇联合使用时,3-4 级不良事件(AE)(AN2025加紫杉醇组82% vs.安慰剂组72%)、严重不良事件(SAE)(AN2025 加紫杉醇组57% vs.安慰剂组47%)或治疗期间死亡率(AN2025 加紫杉醇组20% vs.安慰剂组22%)与单独使用紫杉醇相当。最常见的 3-4 级不良事件是高血糖症(buparlisib 组76例患者中17例 [22%] vs 安慰剂组78例患者中2例 [3%])、贫血(14例 [18%] vs 9例 [12%])、中性粒细胞减少症(13例 [17%] vs 4例 [5%])和疲劳(6例 [8%] vs 8例 [10%])。
基于临床结果,FDA授予AN2025用于治疗铂类药物治疗期间或治疗后疾病进展的复发性或转移性头颈鳞癌的“快速通道”认证资格。
参考文献
1. Lancet Oncol, 2017, 323-335 (pdf).
2. Clin Cancer Res, 2018, 2505-2516 (pdf).